Un Dna da copia e incolla
Mondi biotech Una rivoluzione chiamata Crispr-Cas9, ossia come modificare con facilità e a basso costo il codice genetico, saltando le leggi di Mendel. Il sogno? Sconfiggere malattie ereditarie e accaparrarsi l’esclusiva. Così gli scienziati da accademici diventano imprenditori
Mondi biotech Una rivoluzione chiamata Crispr-Cas9, ossia come modificare con facilità e a basso costo il codice genetico, saltando le leggi di Mendel. Il sogno? Sconfiggere malattie ereditarie e accaparrarsi l’esclusiva. Così gli scienziati da accademici diventano imprenditori
La prossima rivoluzione biotecnologica ha un nome difficile da pronunciare: Crispr-Cas9. Dietro la sigla si cela una tecnica in grado di modificare il codice genetico con efficacia, precisione e facilità d’uso finora mai raggiunti. Le potenzialità aperte dalla tecnica Crispr-Cas9 sono enormi ma sollevano questioni bioetiche altrettanto grandi. Diversi scienziati, tra cui la stessa scopritrice, hanno chiesto di fermare le sperimentazioni cliniche sugli embrioni umani, in attesa di avere maggiori informazioni sui rischi connessi a questo ennesimo salto in avanti delle biotecnologie. Non tutti però condividono questa preoccupazione. La maggior parte dei protagonisti di questa vicenda scientifica sono piuttosto impegnati a racimolare centinaia di milioni di dollari di investimenti da parte di banche e aziende farmaceutiche. L’obiettivo è realizzare il più velocemente possibile applicazioni terapeutiche da brevettare e mettere in commercio.
Il genoma a portata di tutti
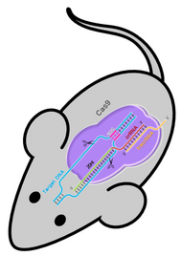
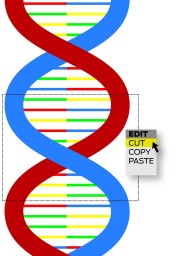
Crispr sta per «Clustered regularly interspaced short palindromic repeats». Si tratta del complesso processo biochimico con cui i batteri riconoscono i virus di precedenti infezioni e li fanno letteralmente a pezzi con l’aiuto di proteine chiamate «Cas9» (vedi box). Nel 2012, si è scoperto come utilizzare questo sistema per modificare il Dna di altre specie. Si riesce così a raggiungere esattamente il punto desiderato nel codice genetico e disattivare o correggere un gene difettoso.
L’obiettivo di modificare il Dna per curare malattie genetiche o realizzare Ogm non è particolarmente innovativo. Di terapie geniche si parla da almeno vent’anni ma con scarsi risultati, per l’imprecisione e la complessità dei metodi tradizionali. Il sistema Crispr però ha facilitato enormemente la modifica del genoma, che ora è alla portata di qualsiasi laboratorio. Secondo alcune stime, bastano poche decine di euro per mettere insieme gli ingredienti necessari ad azionare il meccanismo.
Il campo si sta espandendo rapidissimamente. Sebbene sia stata stata scoperta solo nel 2012, oggi sulla tecnica Crispr vengono pubblicate venti nuove ricerche scientifiche a settimana. Ma il suo impatto è testimoniato soprattutto dal numero di esperimenti in vivo già realizzati. Con questa tecnica sono stati creati cani muscolosi come culturisti, noccioline antiallergiche, maiali bonsai e topi che si ammalano. Varietà vegetali di uso comune potrebbero arrivare sul mercato nel giro di dieci anni, secondo quanto raccontato alla rivista Technology Review da un portavoce della Pioneer Hi-Bred, azienda leader nelle biotecnologie agricole. Gli Ogm creati con la tecnologia Crispr potrebbero avere anche un altro vantaggio. Una variante del metodo messa a punto dal genetista Jin-Soo Kim all’università di Seul permette di «silenziare» i geni di animali e piante senza introdurre Dna proveniente da altre specie. Questi nuovi Ogm potrebbero quindi sfuggire alle normative attuali sulle varietà transgeniche e entrare in commercio più facilmente.
Tanta velocità genera anche timori fondati. E se una tecnica di così facile applicazione fosse utilizzata per progettare a tavolino embrioni umani? In aprile, un team di ricerca dell’università cinese di Sun Yat-sen ha modificato il gene responsabile della beta-talassemia, una grave malattia del sangue, in embrioni non in grado di evolvere in esseri umani. Il gruppo di ricerca guidato da Junjiu Huang è riuscito ad ottenere 28 embrioni immunizzati geneticamente su 86 tentativi. Ma oltre a provocare la mutazione desiderata, Crispr ne ha causate molte altre. Secondo Huang, dunque, la tecnologia è ancora «immatura». Tuttavia, al ritmo con cui viene perfezionata dai ricercatori, il problema delle mutazioni indesiderate potrebbe essere presto risolto. In alcuni studi preliminari, i ricercatori dell’Università di Harvard e del Massachusetts General Hospital (entrambi a Boston) sono già riusciti a ridurre allo 0,1% la probabilità di mutazioni fuori bersaglio. Agire direttamente sugli embrioni non è comunque l’unico modo di realizzare linee cellulari che possono trasformarsi in esseri umani. Si può agire sulle cellule staminali, modificarle con Crispr e trasformarle in cellule germinali, ad esempio. «Il problema non è se, ma quando», ha dichiarato alla Technology Review David Sinclair, uno dei fondatori di un’altra startup denominata OvaScience, inserito da Time nella lista delle 100 persone più influenti nel 2014.
Malaria addio
Utilizzando Crispr si può fare in modo che un gene modificato si trasmetta con maggiore probabilità rispetto agli altri, violando le leggi sulla trasmissione ereditaria scoperte da Mendel. Il sogno di cambiare tutte le zanzare del mondo eradicando la malaria diventa possibile. Gli ecosistemi, però, sono altamente imprevedibili. L’estinzione o l’evoluzione anche di una sola specie può causare effetti a cascata in grado di trasformare rapidamente l’habitat. Saremmo capaci di controllare un simile processo? Molti scienziati ritengono che le cose stiano andando troppo velocemente. Jennifer Doudna dell’università di Berkeley, una delle scopritrici del metodo Crispr, sta combattendo duramente per tenere a bada la sua stessa creatura. Nel gennaio del 2015, ha riunito un gruppo di colleghi a Napa, California per confrontarsi sui rischi connessi alle ricerche in atto. Dall’incontro è nato un appello alla comunità scientifica per scongiurare le sperimentazioni cliniche di Crispr sulle linee germinali umane e dar vita ad un dibattito pubblico sul tema tra società civile, scienziati e istituzioni.
Tra i venti promotori dell’appello, figurano anche vecchie conoscenze come Paul Berg e David Baltimore, entrambi vincitori di premi Nobel per la medicina. Berg e Baltimore nel 1975 organizzarono la conferenza di Asilomar, in California, in cui centoquaranta scienziati si confrontarono pubblicamente sui rischi delle biotecnologie allora agli albori. Lì nacquero le linee guida per le ricerche future sul genoma, fino al divieto di eseguirne alcune troppo pericolose per l’uomo e l’ambiente. Nei decenni successivi, la conferenza divenne un esempio per la capacità di autoregolarsi dimostrata dalla comunità scientifica.
Corsa al brevetto
Probabilmente, l’iniziativa di Doudna non avrà lo stesso successo. Non è un caso se all’appello di Napa mancassero molti protagonisti. Crispr ha generato una competizione globale che vede impegnati gli scienziati sia nella veste di accademici che di imprenditori. Tutti i principali ricercatori su Crispr sono anche nei consigli di amministrazione di società startup dedicate alla brevettazione e alla commercializzazione delle scoperte che giungono dai laboratori. Le società più quotate vedono ai loro vertici Feng Zhang, Jennifer Doudna e Emmanuelle Charpentier, i ricercatori che si contendono il titolo di scopritori della tecnologia Crispr.
I tre competono su diversi piani. Su quello puramente scientifico, Doudna e Charpentier vantano le prime pubblicazioni congiunte sull’argomento nel 2012. Zhang però è riuscito a brevettare la tecnica Crispr nel 2014, diventandone l’inventore ufficiale almeno per il momento. Doudna ha infatti contestato la legittimità del brevetto sostenendo che i suoi studi precedono quelli di Zhang. Un primo verdetto dovrebbe arrivare entro l’anno. Doudna spera di evitare che il brevetto limiti l’accesso alle cure basate su Crispr, ma in realtà anche lei aveva provato a brevettarla e Zhang l’ha battuta sul filo di lana. In un campo in così rapida evoluzione, tuttavia, anche il brevetto di Zhang potrebbe invecchiare rapidamente e risultare meno decisivo nelle future ricadute commerciali.
Pure la corsa agli investimenti è apertissima. Di questi giorni è l’annuncio dell’accordo tra Crispr Therapeutics, la startup fondata da Charpentier, e la Vertex, che investirà 105 milioni di dollari, dopo che Celgene e Glaxo avevano già promesso 90 milioni di dollari. L’azienda co-fondata da Zhang, la Editas, ha dalla sua parte 120 milioni di dollari provenienti da una cordata in cui figura anche Bill Gates. Intellia, di cui Doudna è consulente scientifica, è sostenuta (tra gli altri) dalla farmaceutica Novartis per 70 milioni.
In un panorama tanto frammentato è difficile che gli scienziati riescano a darsi una disciplina comune. Doudna, Baltimore, Berg e compagni però non demordono. Dalla loro, hanno l’appoggio della National Academy of Science, la potente società scientifica statunitense. Sulla spinta del gruppo di Napa, l’Academy ha fissato per i primi di dicembre a Washington un summit internazionale che discuta le implicazioni bioetiche e regoli le applicazioni cliniche della tecnologia Crispr a livello internazionale. Sarà un appuntamento decisivo sia per i «falchi» che per le «colombe». Ma il match più importante si svolgerà all’ufficio brevetti. O, più probabilmente, a Wall Street.
Scheda
I consigli di mema
Gli articoli dall'Archivio per approfondire questo argomento